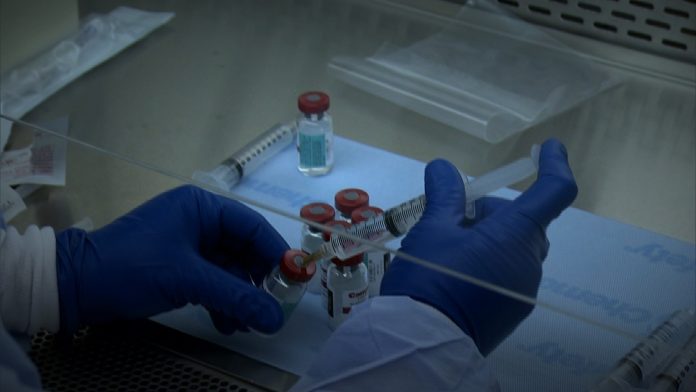
La Comisión Europea autorizó provisionalmente este viernes el uso del medicamento antiviral Remdesivir para el tratamiento de pacientes con coronavirus en la Unión Europea (UE), después del visto bueno de la Agencia Europea de Medicamentos (EMA).
Bruselas ha autorizado la compra-venta del medicamento Remdesivir. Este tratamiento es el primero que se utiliza exclusivamente para mejorar la vida de los pacientes con Covid-19, aunque en un principio se creó para el virus del ébola.
Esto se produce tras la recomendación la semana pasada por parte de la Agencia Europa del Medicamento.
Según los estudios, los pacientes que utilicen Remdesivir se recuperan una media de entre 4 y 6 días antes que el resto de enfermos
«Concedemos esta autorización menos de un mes después de la presentación de la solicitud», dijo la comisaria de Salud, Stella Kyriakides, para quien esto demuestra «la determinación de la UE de responder rápidamente» ante nuevos tratamientos.
La autorización de comercialización condicional se reserva en la UE a aquellos fármacos, cuyos beneficios se estiman mayores a sus riesgos, pese a no contar aún con datos completos. Su duración es de un año renovable.
La autorización de su uso se produce en plena tensión con Estados Unidos.
Después de que el gobierno de Donald Trump confirmara que el país se ha hecho con todas las reservas del medicamento para los próximos tres meses.
Por ello, ahora la Comisión Europea está en negociaciones con Gilead, la compañía que produce el Remdesivir, para asegurar que todos los países europeos también tendrán acceso.
Este movimiento por parte de Estados Unidos ha disparado temores en Europa, porque si Estados Unidos ya ha querido acaparar todo el Remdesivir, ¿qué no será capaz de hacer Donald Trump cuando se cree una vacuna? Por esta razón, Bruselas, está también discutiendo con varias farmacéuticas para que Washington no trate de quedarse con todas las existencias.
La molécula del laboratorio estadounidense Gilead Sciences fue desarrollada para tratar a los pacientes con fiebre hemorrágica del ébola, sin éxito, pero durante un ensayo en Estados Unidos demostró cierta eficacia contra la COVID-19.
Su uso ya fue autorizado en casos de urgencia en Estados Unidos y Japón.
En su recomendación, previa a la autorización de la Comisión con el visto bueno de los 27 países europeos, la EMA propone su uso para adultos y adolescentes a partir de los 12 años que sufren neumonía y necesitan oxígeno.